Diskusjon
Chagas’ sykdom er endemisk i Latin-Amerika, hvor den er en vanlig årsak til hjertedød på grunn av ventrikulære arytmier, hjertesvikt og/eller tromboemboliske hendelser (3, 5). Sykdommen forårsakes av protozoen Trypanosoma cruzi, som oftest overføres vektorbårent via blodsugende chagasteger (6). Sykdommen kan også smitte fra mor til barn, via kontaminert mat, via blod og ved organtransplantasjon.
Infeksjonen er oftest asymptomatisk initialt, men noen få utvikler akutt myokarditt eller meningoencefalitt noen uker etter smitte. Pasientene forblir kronisk infiserte, og 30–40 % utvikler klinisk sykdom etter 10–30 år, oftest i form av kardiomyopati. Hjertetransplantasjon er livreddende behandling ved alvorlig Chagas-kardiomyopati, men det er stor risiko for disseminering av parasitter til transplantatet og reaktivering av sykdommen når pasienten immunsupprimeres (7).
Vår pasient var fulgt opp som anbefalt etter hjertetransplantasjon med PCR-monitorering av Trypanosoma cruzi. Ett år etter transplantasjonen hadde hun reaktivering av Chagas-myokarditt, med arytmier og positive PCR-funn i myokardbiopsi og blod. Det ble implantert hjertestarter og gitt behandling i 90 dager med benznidazol.
Chagas-encefalitt er en sjelden, men alvorlig tilstand. Dødeligheten hos immunsvekkede er rapportert å være 85 % (1, 8). Vår pasienthistorie viser imidlertid at selv ved koma og alvorlige nevrologiske funn kan behandling føre til et liv med normal kognitiv funksjon og uten åpenbare senskader.
Kronisk Chagas’ sykdom er en vanlig tilstand, med risiko for kardiomyopati og gastrointestinal sykdom. Sykdommen er endemisk i Latin-Amerika, men har spredt seg til andre kontinenter ved migrasjon. Prevalensen blant latinamerikanske innvandrere til Europa er estimert til 4 % (9). Flertallet av personer med asymptomatisk kronisk Trypanosoma cruzi-infeksjon er trolig udiagnostiserte, da helsepersonell i ikke-endemiske områder ofte har lite kjennskap til sykdommen.
Vår pasient hadde vært innlagt med arytmi og hjertesvikt i Norge, men diagnosen Chagas-kardiomyopati ble først stilt da hun senere ble innlagt med ventrikkeltakykardi under et opphold i Latin-Amerika. Hjertetransplantasjon er en ikke uvanlig behandling ved Chagas’ sykdom. I Brasil er Chagas-kardiomyopati den tredje vanligste indikasjonen for hjertetransplantasjon (10). Risiko for reaktivering med myokarditt i transplantatet var hele 61 % i en rapport fra USA (7). Det er bakgrunnen for anbefalingen om oppfølging etter transplantasjon med PCR-undersøkelse fra blod og myokard og behandling ved reaktivering, slik vår pasient fikk med påfølgende sykdomskontroll i mange år før hun fikk ny reaktivering med encefalitt. Det anbefales regelmessig monitorering med tanke på reaktivering det første året etter transplantasjon, en måned etter eventuell steroidbehandling for rejeksjon samt dersom det tilkommer feber eller tegn til myokarditt (11).
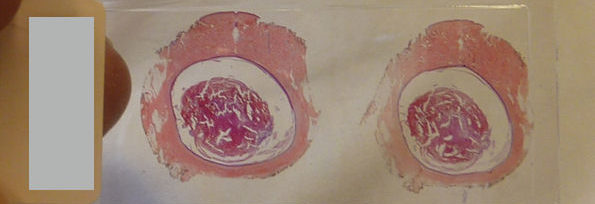
Ved kronisk asymptomatisk Trypanosoma cruzi-infeksjon er serologi med antistoffpåvisning den mest sensitive diagnostiske metoden. Ved akutt infeksjon eller reaktivering kan parasittene ofte påvises i blod eller spinalvæske ved mikroskopi eller PCR. Mikroskopi av spinalvæske ved mistanke om encefalitt er en relativt enkel metode som krever lite ressurser, og i dette tilfellet bidro det til rask avklaring (video). Rutinemikroskopi av grampreparat fra spinalvæske vil ikke påvise infeksjonen, da man må spesialfarge med giemsa for å visualisere parasittene (figur 1). Bakteriedyrkning og standard PCR med sentralnervesystempanel vil være negativ.
Benznidazol og nifurtimox har vist effekt på Trypanosoma cruzi i randomiserte studier (2). Feksinidazol, som brukes mot afrikansk sovesyke forårsaket av Trypanosoma brucei gambiense, er nylig vist å ha effekt mot Chagas’ sykdom i en randomisert studie, men er foreløpig ikke i bruk grunnet bivirkninger med nøytropeni (12). Benznidazol er best undersøkt og har effekt spesielt ved akutt og tidlig kronisk infeksjon. Studier av behandlingseffekt baserer seg på serokonversjon eller PCR-negativitet etter behandling. Den hittil største randomiserte kontrollerte studien av benznidazol hos pasienter med kronisk Chagas’ sykdom og kardiomyopati viste at signifikant flere var PCR-negative etter behandling, men gjennom fem års oppfølging var det ingen effekt på risikoen for forverring av kardiomyopati (13).
Behandling av asymptomatiske seropositive pasienter er ikke undersøkt i større randomiserte studier, men ikke-randomiserte studier har vist redusert risiko for kardiomyopati og redusert mortalitet (14, 15). Behandling av asymptomatiske pasienter er derfor vanlig praksis i de fleste land (16). Behandling anbefales så tidlig i forløpet som mulig, mens hos eldre pasienter med kronisk Chagas’ sykdom og organpåvirkning veies risikoen for bivirkninger opp mot nytten (5). Det finnes ingen behandlingsstudier av encefalitt hos immunsupprimerte, men både benznidazol og nifurtimox har god penetrasjon til sentralnervesystemet, og vi valgte å gi kombinasjonsbehandling til vår pasient da hun var i kritisk forverring etter oppstart med benznidazol.
Chagas’ sykdom er vanligvis en kronisk tilstand der medikamentell behandling ikke haster. Ved akutt infeksjon eller reaktivering er rask behandling viktig. Kontaktinformasjon for rekvirering av benznidazol og nifurtimox og rådgiving om Chagas’ sykdom er tilgjengelig på Verdens helseorganisasjons nettside (17).
Vektorbåren smitte forekommer ikke i Europa, men sykdommen kan overføres fra mor til barn, via blod eller ved organtransplantasjon. I Norge er det innført kontrolltiltak som skal hindre smitteoverføring ved blodtransfusjon (18). Vertikal overføring fra seropositiv mor forekommer ved rundt 5 % av fødsler og hos opptil 30 % hvis mor er PCR-positiv (3). Mer enn 90 % av barn født med smitte blir kurert dersom de behandles i første leveår (2). Benznidazol og nifurtimox er kontraindisert under graviditet, men behandling av fertile kvinner kan hindre smitte i senere svangerskap (19).
Trypanosoma cruzi-antistofftest gjøres ved Nasjonal referansefunksjon for serologisk parasittdiagnostikk ved Universitetssykehuset Nord-Norge. Alle pasienter av latinamerikansk opprinnelse med arytmi, kardiomyopati eller forstørrede viscera bør testes for Chagas’ sykdom. Screening og behandling av Chagas’ sykdom hos asymptomatiske latinamerikanske immigranter i Europa er kostnadseffektivt (16). Antistofftest hos risikogrupper og behandling av seropositive bør anbefales også i Norge for å hindre smitteoverføring i svangerskap og forebygge organkomplikasjoner ved Chagas’ sykdom.
I have noticed that over the course of making a relationship with real estate proprietors, you’ll be able to come to understand that, in every single real estate financial transaction, a payment is paid. In the end, FSBO sellers really don’t “save” the payment. Rather, they fight to earn the commission by doing a great agent’s occupation. In the process, they shell out their money as well as time to conduct, as best they might, the obligations of an representative. Those duties include revealing the home by way of marketing, introducing the home to prospective buyers, making a sense of buyer desperation in order to trigger an offer, making arrangement for home inspections, managing qualification inspections with the mortgage lender, supervising repairs, and aiding the closing.
Hello there, I found your web site via Google while searching for a related topic, your website came up, it looks good. I’ve bookmarked it in my google bookmarks.
I?ve been exploring for a little for any high-quality articles or blog posts on this sort of area . Exploring in Yahoo I at last stumbled upon this website. Reading this info So i am happy to convey that I’ve an incredibly good uncanny feeling I discovered just what I needed. I most certainly will make certain to don?t forget this site and give it a glance on a constant basis.
Thanks for your write-up on this site. From my own experience, often times softening up a photograph may possibly provide the digital photographer with an amount of an imaginative flare. Often however, the soft cloud isn’t what precisely you had as the primary goal and can often times spoil an otherwise good snapshot, especially if you intend on enlarging that.
Greetings from Colorado! I’m bored at work so I decided to check out your site on my iphone during lunch break. I really like the info you present here and can’t wait to take a look when I get home. I’m amazed at how fast your blog loaded on my cell phone .. I’m not even using WIFI, just 3G .. Anyhow, good site!
I’ve been surfing online more than three hours today, yet I never found any interesting article like yours. It is pretty worth enough for me. Personally, if all site owners and bloggers made good content as you did, the net will be a lot more useful than ever before.
Thanks for your tips on this blog. A single thing I want to say is that often purchasing electronics items on the Internet is nothing new. In fact, in the past few years alone, the market for online consumer electronics has grown a great deal. Today, you could find practically any type of electronic tool and other gadgets on the Internet, which include cameras as well as camcorders to computer components and gambling consoles.
Have you ever thought about creating an e-book or guest authoring on other websites? I have a blog centered on the same topics you discuss and would love to have you share some stories/information. I know my visitors would appreciate your work. If you’re even remotely interested, feel free to shoot me an e mail.
I do love the way you have presented this specific challenge and it really does present us a lot of fodder for consideration. Nevertheless, through what I have experienced, I simply just hope when other remarks pile on that people continue to be on issue and don’t start on a soap box of some other news du jour. Still, thank you for this fantastic point and although I can not go along with this in totality, I respect your standpoint.
I really like what you guys are up too. Such clever work and exposure! Keep up the superb works guys I’ve you guys to blogroll.
I?ve been exploring for a little for any high quality articles or blog posts on this kind of area . Exploring in Yahoo I at last stumbled upon this web site. Reading this info So i am happy to convey that I’ve a very good uncanny feeling I discovered exactly what I needed. I most certainly will make sure to do not forget this site and give it a look on a constant basis.
Thanks for the new things you have revealed in your short article. One thing I would really like to comment on is that FSBO associations are built eventually. By releasing yourself to owners the first saturday and sunday their FSBO is actually announced, prior to the masses start out calling on Thursday, you build a good relationship. By mailing them instruments, educational resources, free reviews, and forms, you become a good ally. By subtracting a personal affinity for them and also their circumstances, you build a solid link that, on most occasions, pays off when the owners opt with a representative they know in addition to trust – preferably you.
I am typically to running a blog and i actually recognize your content. The article has really peaks my interest. I am going to bookmark your website and keep checking for brand new information.
It’s the best time to make a few plans for the long run and it’s time to be happy. I’ve learn this submit and if I may I wish to counsel you some attention-grabbing issues or tips. Maybe you could write next articles relating to this article. I wish to learn more issues approximately it!
It?s hard to search out educated individuals on this subject, but you sound like you realize what you?re talking about! Thanks
Spot on with this write-up, I really assume this website wants much more consideration. I?ll in all probability be again to read much more, thanks for that info.
Great post. I was checking constantly this weblog and I’m inspired! Very useful info particularly the closing section 🙂 I handle such information a lot. I was looking for this certain information for a long time. Thanks and good luck.
What i don’t realize is in truth how you’re now not actually a lot more smartly-appreciated than you might be right now. You are very intelligent. You know therefore significantly when it comes to this topic, produced me in my opinion imagine it from a lot of various angles. Its like women and men aren’t fascinated unless it is one thing to accomplish with Lady gaga! Your personal stuffs outstanding. Always care for it up!
It?s actually a great and helpful piece of information. I am glad that you shared this useful information with us. Please keep us up to date like this. Thanks for sharing.
Thanks for your post. I’d prefer to write my opinion that the price of car insurance varies from one insurance policy to another, since there are so many different facets which give rise to the overall cost. For example, the model and make of the motor vehicle will have a tremendous bearing on the purchase price. A reliable ancient family automobile will have a lower priced premium than just a flashy sports car.
I do agree with all the ideas you have presented in your post. They are very convincing and will certainly work. Still, the posts are very short for starters. Could you please extend them a little from next time? Thanks for the post.
okmark your blog and check again here regularly. I am quite certain I will learn a lot of new stuff right here! Best of luck for the next!
Do you mind if I quote a couple of your posts as long as I provide credit and sources back to your weblog? My website is in the exact same niche as yours and my users would definitely benefit from some of the information you present here. Please let me know if this alright with you. Thank you!
One important thing is that while you are searching for a education loan you may find that you’ll need a co-signer. There are many cases where this is correct because you might find that you do not employ a past credit standing so the loan provider will require that you have someone cosign the credit for you. Good post.
It’s a shame you don’t have a donate button! I’d definitely donate to this superb blog! I guess for now i’ll settle for book-marking and adding your RSS feed to my Google account. I look forward to new updates and will share this site with my Facebook group. Chat soon!
After study a couple of of the blog posts in your web site now, and I truly like your approach of blogging. I bookmarked it to my bookmark website listing and will likely be checking again soon. Pls take a look at my web page as effectively and let me know what you think.